FH Technikum Wien forscht an künstlichen Nerventransplantaten
30. Mai 2023
Neue Wege in der Therapie peripherer Nervenverletzungen sowie eine mögliche Alternative zu Tierversuchen.
Ein Forscher*innen-Team der FH Technikum Wien arbeitet an vielversprechenden künstlichen Nerventransplantaten, um periphere Nervenverletzungen zu behandeln. Außerdem können die Entwicklungen am Technikum dazu beitragen, Tierversuche zu reduzieren.
Periphere Nervenverletzungen sind Nervenverletzungen außerhalb des Gehirns, beispielsweise in den Nerven der Hand, etwa durch einen Unfall. Solche Schäden beeinträchtigen die Lebensqualität von Patient*innen erheblich und können zum Verlust motorischer und sensorischer Funktionen führen. Die derzeitige Therapie basiert auf Nerventransplantaten aus dem eigenen Körper, was jedoch mit Funktionseinbußen des Spender-Nervs einhergeht – man opfert einen gesunden Nerv, um die Funktion des verletzten Nervs wiederherzustellen.
„Es gibt dringenden Bedarf an alternativen Therapien, wie beispielsweise die Herstellung künstlicher Nerventransplantate, deren Erforschung und Entwicklung sich mein Team zum Ziel gesetzt hat“, sagt Andreas Teuschl-Woller, Leiter des Forschungsschwerpunkts Tissue Engineering & Molecular Life Science Technologies an der FH Technikum Wien.
Innovativer Ansatz mit Patentanmeldung
Forscherin Carina Hromada verfolgt hier einen Ansatz, der die natürlichen Regenerationsprozesse im Körper nach Nervenverletzungen zum Vorbild nimmt. Nach Nervenverletzungen können sogenannte Gliazellen (auch „Schwann-Zellen“ genannt) längs verlaufende Zellbahnen (Büngner-Bänder) zwischen den durchtrennten Nervenenden bilden, die als Leitstrukturen für regenerierende, nachwachsende Axone dienen.
Im Detail:
- Carina Hromada erforscht den Ansatz, längs ausgerichtete Schwann-Zellen in einer biokompatiblen Matrix zu entwickeln.
- Für diese künstlichen Büngner-Bänder werden Schwann-Zellen in dreidimensionale Proteinhydrogele eingebettet, auf eine spezielle Hakenhalterung aufgebracht und anschließend mit Hilfe des eigens entwickelten „MagneTissue“ Bioreaktors mechanisch trainiert.
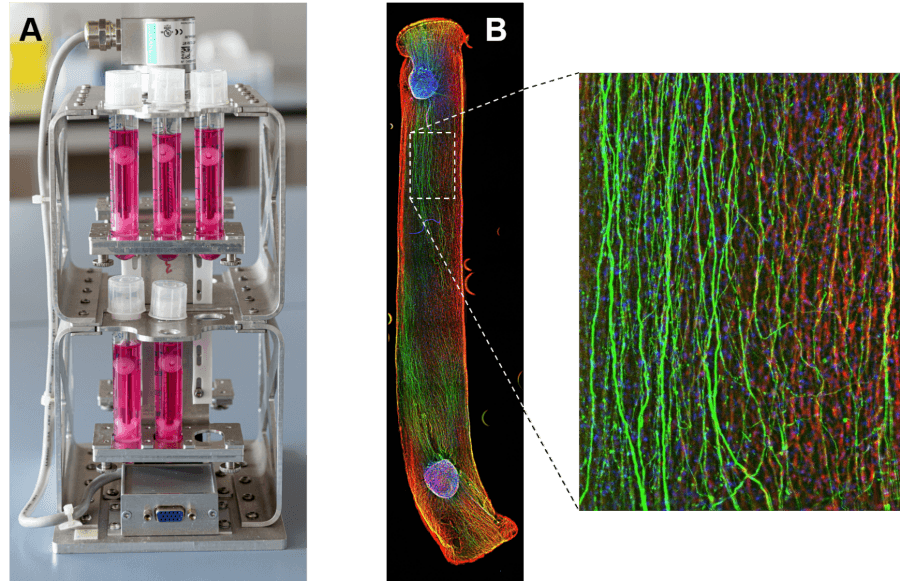
- Schwann-Zellen können damit einer Zugspannung ausgesetzt werden, indem ein in die Hakenhalterung integrierter Magnet mit einem externen motor-gesteuerten Magnet des Bioreaktors interagiert (Abb. 1A).
- Dies führt zu einer longitudinalen Ausrichtung entlang der Zug-Achse und Ausbildung eines speziellen regenerativen Phänotyps der Schwann-Zellen, wie er auch in Büngner-Bändern vorzufinden ist.
Die innovative Idee der Ausrichtung von Schwann-Zellen unter Zuhilfenahme aktiver mechanischer Stimulierung ließ sich das Forschungsteam der FH Technikum Wien international mit einer Patentanmeldung schützen.
Neues Regenerationsmodell
Um die Regenerationsfähigkeit der künstlichen Nerventransplantate im Körper vorhersagen zu können, arbeitet Hromada zudem an der Etablierung eines zell-basierten Regenerationsmodells für periphere Nerven, welches die regenerativen Prozesse nach Verletzungen außerhalb des Körpers nachstellen soll.
Im Detail:
- Hierbei werden die Schwann-Zellkonstrukte mit Dorsalwurzelganglien kombiniert und das Auswachsen von Axonen entlang der zuvor ausgerichteten Schwann-Zellen untersucht.
- Dabei zeigte sich, dass sich regenerierende Axone, wie erhofft, entlang der künstlichen Büngner-Bänder orientieren und damit das Konstrukt erfolgreich innervieren (Abb. 1B) – und dieses somit auch in Zukunft eine vielversprechende Alternative zu körpereigenen Transplantaten in der Klinik darstellen könnte.
Die langjährige Zusammenarbeit mit dem Ludwig Boltzmann Institut (LBI) für Traumatologie (das Forschungszentrum in Kooperation mit der AUVA), konkret mit der Gruppe für Neuroregeneration von David Hercher, ermöglicht es, die Forschungsergebnisse in einen klinischen Kontext zu bringen. Dies ist ein essentieller Schritt um solche zell-basierten Therapien gezielt für ihren klinischen Einsatz zu entwickeln.
Weitere Chancen u.a. in Reduktion von Tierversuchen
Die oben erwähnten Nerven-ähnlichen Axon-Schwann-Zellkonstrukte bieten eine Vielzahl weiterer Möglichkeiten, die aktuell ausgetestet werden. Aktuell wird an der Kombination mit Makrophagenmodellen im Rahmen des Stadt Wien Projekts „ImmunTissue“ (MA23 30-06) gearbeitet, die zur weiteren Evaluierung der Konstrukte dienen sollen. Diese Modelle haben auch weitere Relevanz für Forschung und klinische Anwendung als mögliche Drug-Screening-Plattform, um potenziell neurotoxische Auswirkungen von neuen und etablierten Medikamenten (welche z.B. als spezielle Chemotherapeutika angewendet werden) zu entdecken. Dadurch können Tierversuche und damit verbundene Kosten nicht nur signifikant reduziert werden, sondern auch der Erfolg klinischer Studien besser vorhergesagt werden.
Am Bild: Entwicklung von künstlichen Büngner-Bändern. Bild A: Mit dem „MagneTissue“ Bioreaktor werden Schwann-Zellen in Proteinhydrogelen mit Hilfe zweier Magneten longitudinal ausgerichtet. Bild B: Die künstlichen Büngner-Bänder werden in einem Regenerationsmodell bezüglich ihrer Regenerationsfähigkeit getestet. Axone (grün) wachsen wie erhofft entlang der longitudinal ausgerichteten Schwann-Zellen (rot); blau: Zellkerne. Copyright für beide Bilder: FH Technikum Wien.
Links/ Wissenschaftliche Publikationen
- [1] https://www.technikum-wien.at/forschungsschwerpunkt-tissue-engineering-molecular-life-science-technologies/
- [2] https://www.technikum-wien.at/personal/carina-hromada
- [3] Heher P, Maleiner B, Prüller J, Teuschl AH, Kollmitzer J, Monforte X, Wolbank S, Redl H, Rünzler D, Fuchs C. A novel bioreactor for the generation of highly aligned 3D skeletal muscle-like constructs through orientation of fibrin via application of static strain. Acta Biomater. 2015 Sep;24:251-65. doi: 10.1016/j.actbio.2015.06.033. Epub 2015 Jun 30. PMID: 26141153.
- [4] Tomasch J, Maleiner B, Hromada C, Szwarc-Hofbauer D, Teuschl-Woller AH. Cyclic Tensile Stress Induces Skeletal Muscle Hypertrophy and Myonuclear Accretion in a 3D Model. Tissue Eng Part A. 2023 May;29(9-10):257-268. doi: 10.1089/ten.TEA.2022.0182. Epub 2023 Mar 1. PMID: 36606693
- [5] Teuschl-Woller A, Hromada C (2021). Cell Construct Comprising Schwan Cells or Schwann Cell-Like Cells and a Biocompatible Matrix (International Publication Number WO 2021/260137 A1).
- [6] https://www.technikum-wien.at/forschungsprojekte/immuntissue-makrophagenbasierte-in-vitro-analysenplattform-zur-biologischen-implantattestung/